因有效性尚不明确,关于药效的相关言论具有误导性,博瑞医药董事长收到警示函。
博瑞医药董事长收警示函 因个人试药言论具有“误导性”
10月17日晚间,博瑞医药发布一则关于董事长收到江苏证监局警示函的公告。公告称,公司董事长袁建栋于近日收到中国证券监督管理委员会江苏监管局下达的《江苏证监局关于对袁建栋采取出具警示函措施的决定》([2023]143号)(以下简称“警示函”)。
根据上述警示函,经查,袁建栋作为博瑞医药董事长、总经理,在2023年10月12日下午召开的“大咖解读GLP-1全产业链系列交流会”电话会议上发布了袁建栋个人试用公司在研产品BGM0504注射液相关情况。目前BGM0504注射液用于减重尚处于临床试验阶段,有效性尚不明确,其关于药效的相关言论具有误导性,违反了《上市公司信息披露管理办法》(证监会令第182号,以下简称《信披办法》)第四十九条第二款的规定。
上述警示函指出,根据《信披办法》第五十二条的规定,江苏证监局决定对袁建栋采取出具警示函的行政监管措施,并记入证券期货市场诚信档案。袁建栋应认真汲取教训,加强对证券法律法规的学习,保证披露信息的真实、准确、完整,杜绝此类违规行为再次发生,并在收到本决定书之日起十个工作日内向江苏证监局提交书面报告。
公司公告称,在警示函所述事项发生后,公司于2023年10月14日及时披露《股票交易风险提示公告》(公告编号:2023-074)。公司相关人员高度重视警示函中指出的问题,将认真吸取教训,加强对《证券法》《上市公司信息披露管理办法》《上海证券交易所科创板股票上市规则》等相关法律法规、规范性文件的学习,杜绝此类违规行为再次发生。公司将继续加强董监高人员依法履职的培训力度,提升规范运作水平,强化信息披露管理,切实维护公司及广大投资者的利益。公告称,本次监督管理措施不会影响公司的正常经营管理活动。
此前的10月16日晚间,博瑞医药发布股票交易异常波动公告称,公司BGM0504注射液尚处于研发阶段。截至公告披露日,减重和2型糖尿病治疗两项适应症均仅获得Ⅱ期临床试验伦理批件,其中2型糖尿病治疗的Ⅱ期临床已开始入组。待II期临床试验完成后,尚需经国家药品监督管理局(以下简称“国家药监局”)确认确证性临床试验方案,开展并完成III期临床研究,并经国家药监局审评、审批通过后方可生产上市。创新药研发周期长、研发投入大,各项临床研究的入组及研究方案实施等受到多种不确定因素影响,临床研究存在结果不及预期甚至临床研究失败的风险。
近期减肥药概念股遭到市场爆炒
记者发现,近期A股市场减肥药概念股受到市场关注,在公告、互动平台、调研等多种场合提及减肥话题的公司,很多都被视为减肥概念股,遭到市场爆炒。
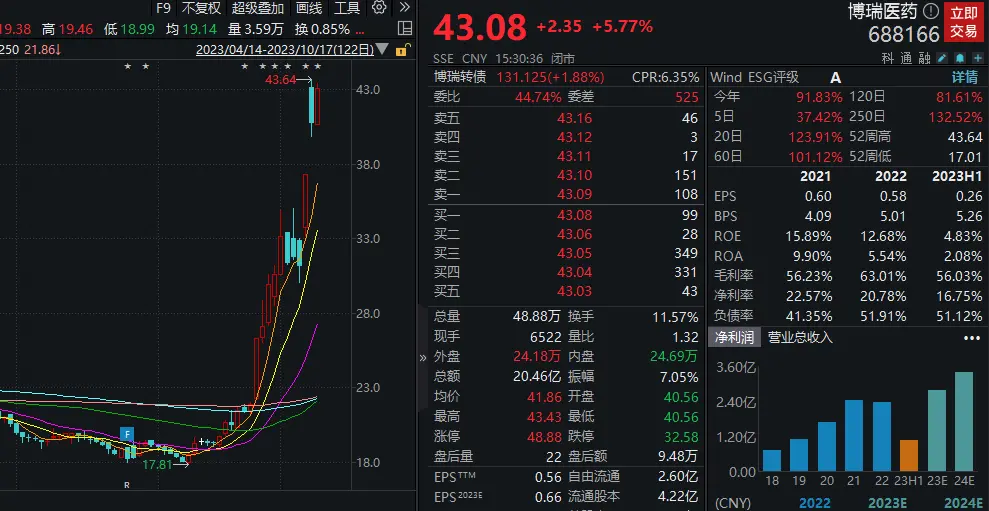
博瑞医药的涨势就异常猛烈。
据行情和Wind数据显示,9月以来,博瑞医药股价开始连续上涨,在短短一个多月的时间股价距9月低位的最大涨幅高达145%。
常山药业、瀚宇药业也一度被市场视为减肥概念股,股价也遭到爆炒,从9月低位的最大涨幅也均超过100%,常山药业期间最大涨幅甚至超过300%。
而在此前的10月16日晚间,康惠制药发布澄清说明公告称,近日,公司在E互动回复称公司控股孙公司陕西友帮涉及生产减肥药司美格鲁肽、替泊尔肽中间体相关事项,公司针对上述事项进行澄清并做风险提示。公告称,公司控股孙公司陕西友帮是一家集高纯度原料药及高端医药中间体技术研发、生产、销售、技术转让、CRO、CMO、CDMO外包为一体的高科技企业。陕西友帮是公司2020年9月收购的控股孙公司,受市场整体环境影响,自2020年10月并表以来,陕西友帮持续亏损,2023年上半年实现营业收入1,651.19万元,亏损753.01万元,2020年10月至2022年12月,累计亏损3,032万元。
上述公告称,陕西友帮目前正在进行司美格鲁肽及替泊尔肽中间体的小试生产,小试完成后还需完成中试阶段才可进行规模化生产。陕西友帮目前不具备司美格鲁肽及替泊尔肽中间体的生产能力,公司目前没有其他减肥类药物的生产及销售。
康惠制药表示,前期回复引起了部分投资者误会和误解,对此,公司及公司证券部门诚恳向投资者表示歉意,并将积极吸取经验教训,进一步完善相关制度和程序,持续学习相关产业政策和文件,努力提升与投资者互动沟通的严谨性与信息传递的完整性,不断提升公司信息披露水平。
百花医药10月16日晚间发布股票交易风险提示公告称,公司回复“公司全资子公司华威医药可以为客户提供利拉鲁肽注射液及司美格鲁肽注射液的相关药品研发服务”,可能对投资者产生误导,公司予以道歉。
百花医药公告称,公司仅开展了利拉鲁肽、司美格鲁肽项目的合成路线筛选、小试试验启动前期研究工作,后续研发存在重大不确定性。目前没有任何客户向公司委托研发,公司无相关药品生产和销售。
公告称,公司在回复中涉及的“在研项目中有一项减肥类产品”,仅有奥利司他胶囊。该项目自2022年7月开始进行药物研发,目前处于进入临床研究阶段。临床研究结束后尚需经国家药监局审评、审批通过后委托客户方可取得药品批件。该受托研发项目合同金额不超过1100万元,2022年度收入仅有100万元左右,该项目不会对公司业绩产生重大影响。
另外,部分投资者关注的公司涉及的老年痴呆适用药物多奈哌齐片,目前未接受任何客户委托。公司接受客户委托开展并确认收入的老年痴呆药物仅有盐酸美金刚缓释胶囊临床服务业务,2019年已完成临床试验工作,已将研发成果转交客户,项目收入全部确认完毕。更多股票资讯,关注财经365!